电解水能量效率计算时遇到的问题:
1. 库仑量与产量的换算关系?2. 1度电能产生多少氢气?
3. 产生1立方氢气需要多少电量?4. 法拉第效率怎么算? 水电解制氢设备
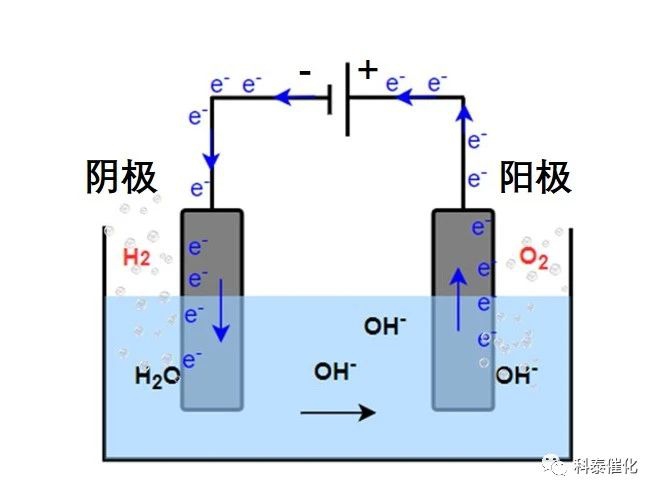 电解水是在阴极上析出氢气,阳极上析出氧气的过程,根据电解液的性质两电极反应会有所不同,但总反应都是相同的。
电解水是在阴极上析出氢气,阳极上析出氧气的过程,根据电解液的性质两电极反应会有所不同,但总反应都是相同的。
通电:H2O→H2+1/2 O2
通电后在电势驱动下发生电子的定向移动,电子不会凭空产生、也不会凭空消失,阳极失电子数=阴极得电子数。
电量用Q来表示:
Q=I*t (1)
Q:电量,单位库仑(C)I:电流,单位安培(A)t:时间,单位秒(s)
电量Q代表通过的电流在一段时间内的积分,也等于通过的所有电子的电量总和。对于某一电极反应,电荷量Q可表示为:
Q=n*N0*e*Z (2)Q:电量,单位库仑(C)n:物质的量,单位摩尔(mol)
N0:阿伏伽德罗常数等于1mol物质的原子个数,其值约为6.022x1023 个,单位每摩尔( mol-1)
e:单个电子所带电量,约为 1.602x10-19,单位库仑(C)
Z:反应的电子转移数
其中,每摩尔电子所携带的电荷为1法,法拉第常数F的值约为 96485 库仑/摩尔 (C/mol),即:
F=1*N0*e (3)
298.15K,101.3Kpa的标准状态下,液态水的的标准Gibbs生成自由能是-237.1kJ/mol,反过来电解水消耗的能量就是237.1kJ/mol。在无能量损耗且效率100%转化的的最理想状况下:
1度电(3600 KJ)能生产15.81 mol氢气 ~ 30.37 g氢气 ~ 0.34 m3氢气(理想气体)。
理想情况下,1 m3氢气仅需2.94度电(1÷0.34),但在实际应用中电解液的电阻损耗很大,发热严重,所以电解效率很低,一般只能达到30%-50%,所以每立方米氢气电耗为4.5~5.5度左右。
【液态水的的标准Gibbs生成自由能(-237.1kJ/mol)与氢气的燃烧热(285.8KJ/mol)分别对应电池电动势中的理论分解电压1.23 V和热中性电压1.48 V——下期内容。】
法拉第效率FE(Faradaic efficiency)的计算:
文献中常见到的法拉第效率通常是指一定电量下,实际生成目标产物的产量与理论产量的比值,或实际生成目标产物的电量与理论消耗电量的比值,用来判断反应有没有副产物发生。
FE=n实际/n理论*100%=Q实际/Q理论*100% 高纯氢气发生器
n是物质的量,实际收集的物质的量n可以换算成实际电量Q,理论电量Q可以从工作站获取。
比如要算氢气的FE,可以利用排水法(有误差)、气相色谱收集氢气的体积V,换算成物质的量n,可得到对应的转移电子的物质的量n*Z,得到实际电量Q,与理论消耗电量之比就是氢气的FE。


